Tập đoàn ViiV Healthcare đang bổ sung loại thuốc dự phòng HIV tác dụng kéo dài đầu tiên trên thế giới vào chương trình chia sẻ bằng sáng chế chỉ sau bảy tháng kể từ khi FDA phê duyệt.
Tập đoàn ViiV Healthcare đang bổ sung loại thuốc dự phòng HIV tác dụng kéo dài đầu tiên trên thế giới vào chương trình chia sẻ bằng sáng chế chỉ sau bảy tháng kể từ khi FDA phê duyệt.
GSK đã ký thỏa thuận cấp phép với Tổ chức Bằng sáng chế Thuốc do Liên hợp quốc hậu thuẫn (MPP) cho loại thuốc HIV PrEP tác dụng kéo dài Apretude, hay cabotegravir, được hai bên công bố trong Hội nghị AIDS Quốc tế lần thứ 24. Thỏa thuận này trao cho các nhà sản xuất thuốc generic được lựa chọn quyền sản xuất và cung cấp các sản phẩm sao chép của Apretude cho 90 quốc gia đang phát triển.
“Nếu bạn nghĩ về đại dịch HIV, thì gánh nặng lớn nhất là ở vùng cận Sahara,” trưởng bộ phận R&D của ViiV, Kimberly Smith, M.D., cho biết trong một cuộc phỏng vấn với Fierce Pharma. “Vì vậy, nếu chúng ta thực sự muốn thay đổi quỹ đạo của dịch bệnh, chúng ta phải cung cấp công cụ phòng ngừa đáng chú ý này ở những nơi cần nó nhất”.
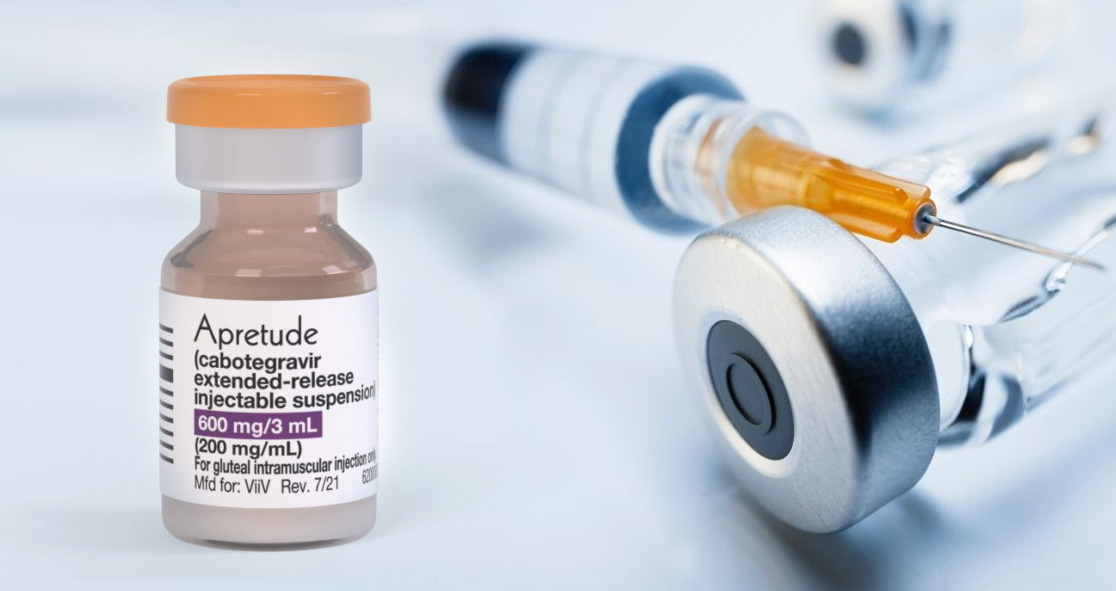
ViiV hiện tính phí Apretude với giá niêm yết là $ 3,700 một lọ, hoặc $ 22,200 mỗi năm. Nghiên cứu của Clinton Health Access Initiative đã phát hiện ra rằng các nhà sản xuất thuốc generic có thể sản xuất cabotegravir với giá $ 2,60 mỗi lọ, theo tổ chức Bác sĩ không biên giới.
Đồng thời tại AIDS 2022, Tổ chức Y tế Thế giới đã công bố các hướng dẫn mới khuyến nghị sử dụng cabotegravir là thuốc PrEP để dự phòng HIV. Cũng tại hội nghị, ViiV, tổ chức phi lợi nhuận AVAC tập trung vào phòng chống HIV, Quỹ Bill & Melinda Gates, Quỹ đầu tư cho trẻ em, MedAccess và Unitaid đã chung tay hợp tác chiến lược để tăng tốc độ tiếp cận và bình đẳng với Apretude điều trị dự phòng trước phơi nhiexm HIV - PrEP. Tập đoàn sẽ tạo điều kiện thuận lợi cho các cuộc thảo luận về giá cả đối với các giao dịch mua tiềm năng của chính phủ.
Các thông báo được đưa ra khi Apretude được ra mắt sớm tại Hoa Kỳ sau khi FDA chấp thuận vào tháng 12 như một lựa chọn sử dụng PrEP hai tháng một lần để ngăn ngừa HIV ở những người có nguy cơ, hoặc hơn hai năm sau khi loại thuốc này được công bố đầu tiên trên toàn cầu ở Canada như một phần của kết hợp điều trị HIV cùng với thuốc rilpivirine của Johnson & Johnson. Nó cũng theo sau tuyên bố của ViiV vào tháng 5 rằng họ đang đàm phán các điều khoản cấp phép với MPP.